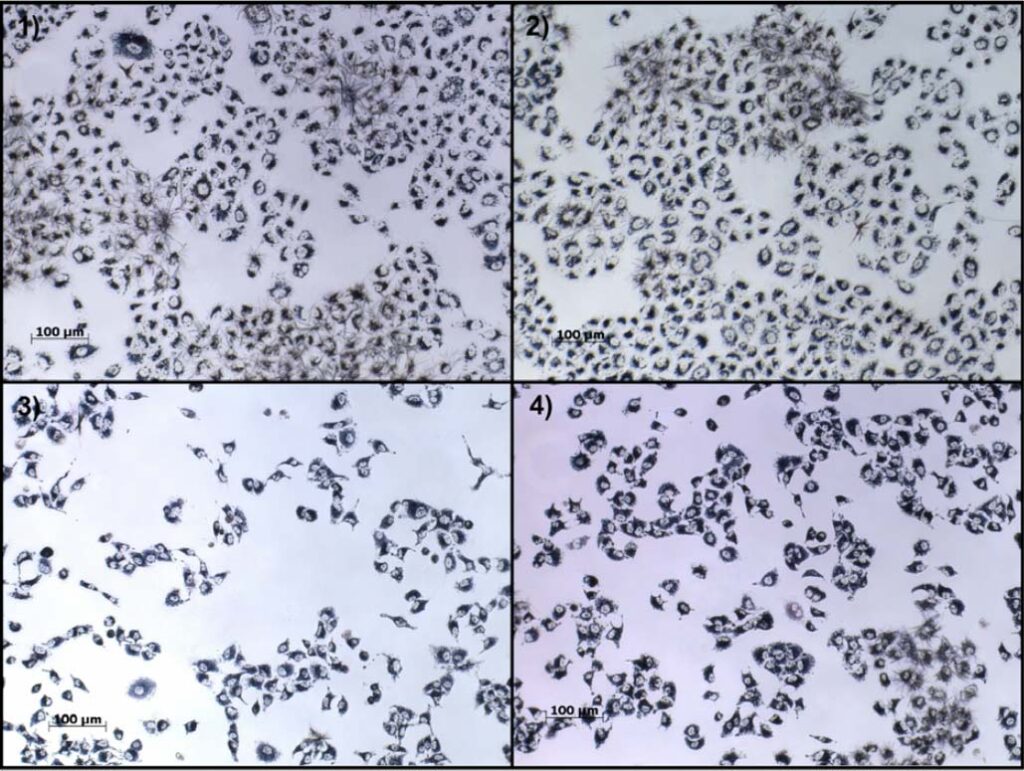
Die Lebensfähigkeit der Zellen in Zytotoxizität Assays wird immer relativ zu unbehandelten Kontrollzellen berechnet, die demselben Aussaat- und Expositionsverfahren unterzogen werden, aber nur Rohextraktionsmedien erhalten, die ohne den Testgegenstand inkubiert wurden. Darüber hinaus wird das für eine bestimmte Vertiefung im Assay gemessene spektrometrische Signal immer durch Leerwerte im Assay korrigiert, bei denen der Absorptionshintergrund in Vertiefungen gemessen wird, die das Assay-Reagenz erhalten haben, aber ohne Zelle inkubiert wurden. Die Variabilität der gemessenen Absorption innerhalb der Leerwerte sowie innerhalb der unbehandelten Kontrollzellen hängt stark von der Art des durchgeführten Assays und dem Verfahren und den Parametern ab, die für die Aussaat der Zellen, die Inkubation und die Exposition mit dem Assay-Reagenz gewählt wurden.
Die Quellen der Variabilität für das gemessene Absorptionssignal, das zwischen Leerwerten und unbehandelten Kontrollzellen gemessen wird, hängen von Parametern wie der gewählten Zellaussaatdichte, der Dauer der Zellproliferations-/Anheftungsphase vor der Extraktexposition und der Dauer der Inkubationszeit des Testreagenzes ab. Insgesamt bestimmen das Verfahren und die Parameter, die für einen bestimmten Assaytyp gewählt werden, dessen spezifische Empfindlichkeit. Oder anders ausgedrückt: Je höher die Variabilität des gemessenen spektrometrischen Signals innerhalb der Leerwerte bzw. der unbehandelten Kontrollzellen ist, desto geringer ist die Fähigkeit des Assays, geringfügige Auswirkungen der Extrakte auf die Lebensfähigkeit der Zellen zu erfassen. Parameter, die einen starken Einfluss auf die Grundlinienvariabilität eines Assays haben, werden daher in der Regel während der Assayentwicklung optimiert (Lutter et al., 2017; Matt, 2008). Mindestanforderung an einen quantitativen Zytotoxizitätstest zur Einhaltung der ISO 10993-5 ist es, bei der Validierung nachzuweisen, dass eine Abnahme der Zelllebensfähigkeit um 30% oder mehr ein statistisch signifikanter Effekt ist und nicht nur ein zufälliger Effekt aufgrund der Grundlinienvariabilität des Assays. Die Variabilität zwischen den Assays in Bezug auf die beobachtete zytotoxische Wirkung eines Extrakts kann auf die Tatsache zurückzuführen sein, dass die kolorimetrische Veränderung der Assay-Reagenzien mit verschiedenen zellulären Funktionen wie der Mitochondrienfunktion (MTT, XTT, WST-1, Resazurin), der lysosomalen Integrität (Neutralrot), dem Zellwachstum (Sulforhodamin B, BCA) bzw. der Membranintegrität (Trypanblau) verbunden ist. Darüber hinaus können Rückschlüsse von extrahierten Chemikalien auf die Umwandlung des Testreagenzes einen Einfluss auf das Ausmaß der gemessenen zytotoxischen Wirkung haben (Scarcello et al., 2020). Je nach der Art der Wechselwirkung der extrahierten Chemikalien mit dem Testreagenz kann dies zu falsch positiven oder falsch negativen Ergebnissen führen.
