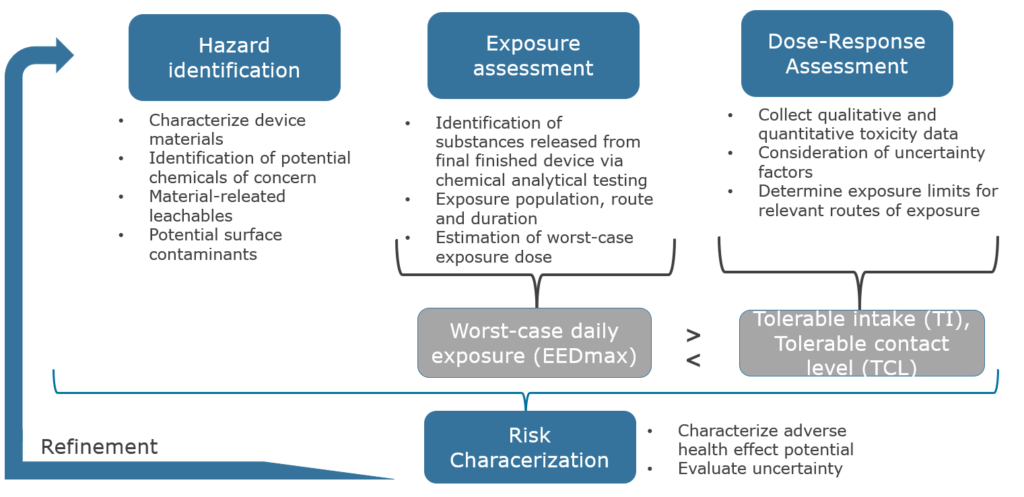
A toxikologische Risikobewertung oder TRA ist ein mehrstufiges Verfahren zur Abschätzung des Risikos gesundheitsschädlicher Wirkungen durch die Exposition gegenüber aus einem Medizinprodukt herauslösbaren Stoffen. Es umfasst die wissenschaftliche Überprüfung und Bewertung aller relevanten wissenschaftlichen Daten über die Toxizität einer bestimmten Verbindung oder eines Gemischs und die Exposition gegenüber dieser Verbindung (Younes, 2014). Bestandteile einer toxikologische Risikobewertung sind in der Abbildung dargestellt.
Dienstleistungen zur toxikologischen Risikobewertung Die von Medical Matters (MM) durchgeführten toxikologischen Risikobewertungen zeigen mögliche Gesundheitsrisiken für Patienten auf, wie z. B. Haut-/Augenreizung, Hautsensibilisierung, Genotoxizität usw., indem ein Erzeugnis und seine Inhaltsstoffe anhand der verfügbaren Informationen aus In-silico-Methoden (z. B. QSAR und Read-Across), In-vitro-Tests, Tierstudien und epidemiologischen Daten bewertet werden. Ziel einer von MM durchgeführten toxikologischen Risikobewertung ist es, sicherzustellen, dass die fertigen Endprodukte biologisch sicher sind, und potenzielle toxikologische Risiken in einem frühen Stadium der Produktentwicklung zu minimieren. Wenn keine Informationen über bestimmte Inhaltsstoffe vorliegen, berät MM bei der Durchführung von Toxizitätstests, um festzustellen, ob die Inhaltsstoffe ein signifikantes Risiko darstellen. MM berät seine Kunden, welche Dienstleistungen am besten geeignet sind, um ihre speziellen Anforderungen zu erfüllen. Darüber hinaus werden alle Bewertungen und Tests so durchgeführt, dass sie den Anforderungen der Regulierungsbehörden entsprechen, um einen kontinuierlichen Marktzugang in etablierten und neuen geografischen Märkten zu gewährleisten. Die TRA:s bei MM werden in Übereinstimmung mit den neuesten regulatorischen Standards und Richtlinien durchgeführt. Gund in Kontakt für mehr Hintergrundinformationen über TRA:s und die MM-Weißbuch zu diesem Thema.
